Quelques bases sur le verre et sa coloration.
 Quelques bases sur le verre et sa coloration.
Quelques bases sur le verre et sa coloration.
En cours recherche sur le fameux bleu de certains vitraux de Chartres, il m'a semblé nécessaire de rappeler certaines bases sur le verre, utiles pour ne pas décrocher. Elles sont communes à tous les sujets vitraux, donc mieux valait créer un sujet à part.
SOMMAIRE :
Silice, silicium, quartz ...
Coloration naturelle du quartz. Améthyste, citrine, amétrine, quartz fumé, quartz Morion, quartz hématoïde ...
Les fondants.
Un choix de vidéos sur la fabrication du verre.
La transformation du sable en verre suivie en temps réel.
La transformation du sable en verre suivie en temps réel (2)
Le verre, solide non cristallin amorphe.
Création naturelle de verre à partir de sable, sans fondant !
Dernière édition par Northman le Mer 16 Mar - 18:15, édité 4 fois
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Silice, silicium, quartz ...
Silice, silicium, quartz ...
Le composant principal du verre, et donc en particulier de celui des vitraux, est la silice, SiO2, dioxyde de silicium. On le voit dans le tableau ci-dessous, concernant les verres modernes :
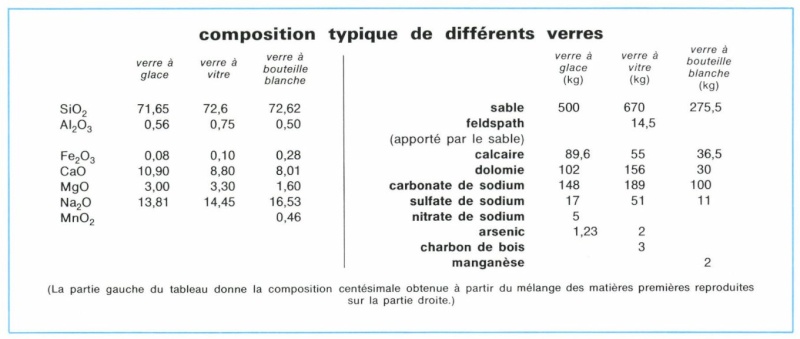
La silice représente 71,65% de la composition du verre à glace, 72,6% du verre à vitre et 72,62% du verre à bouteille blanche.
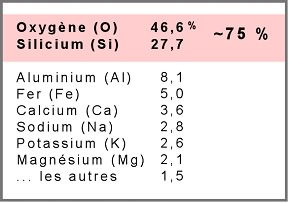
Après l'oxygène, le silicium est le second élément le plus abondant de l'écorce terrestre :
Sous forme cristalline, la silice donne le quartz, roche parfois translucide :

Structure cristalline du quartz :
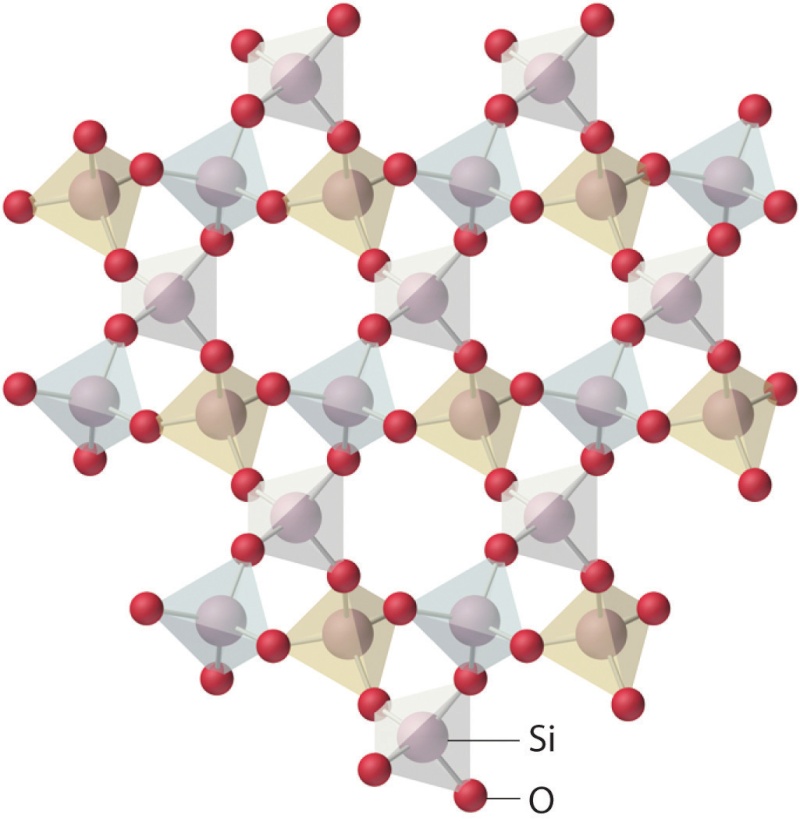
Au sein de la structure ci-dessus, chaque atome de silicium (Si, en gris) est relié à quatre atomes d'oxygène (O, en rouge).
Et chaque atome d'oxygène est relié à deux atomes de silicium.
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Coloration naturelle du quartz. Améthyste, citrine, amétrine, quartz fumé, quartz Morion, quartz hématoïde ...
Coloration naturelle du quartz. Améthyste, citrine, amétrine, quartz fumé, quartz Morion, quartz hématoïde ...
C'est très vraiment intéressant pour faire ensuite le parallèle avec la coloration des vitraux : Le quartz peut être naturellement coloré. En voici différentes déclinaisons.
La liste n'est pas exhaustive :
AMETHYSTE :
[/url]
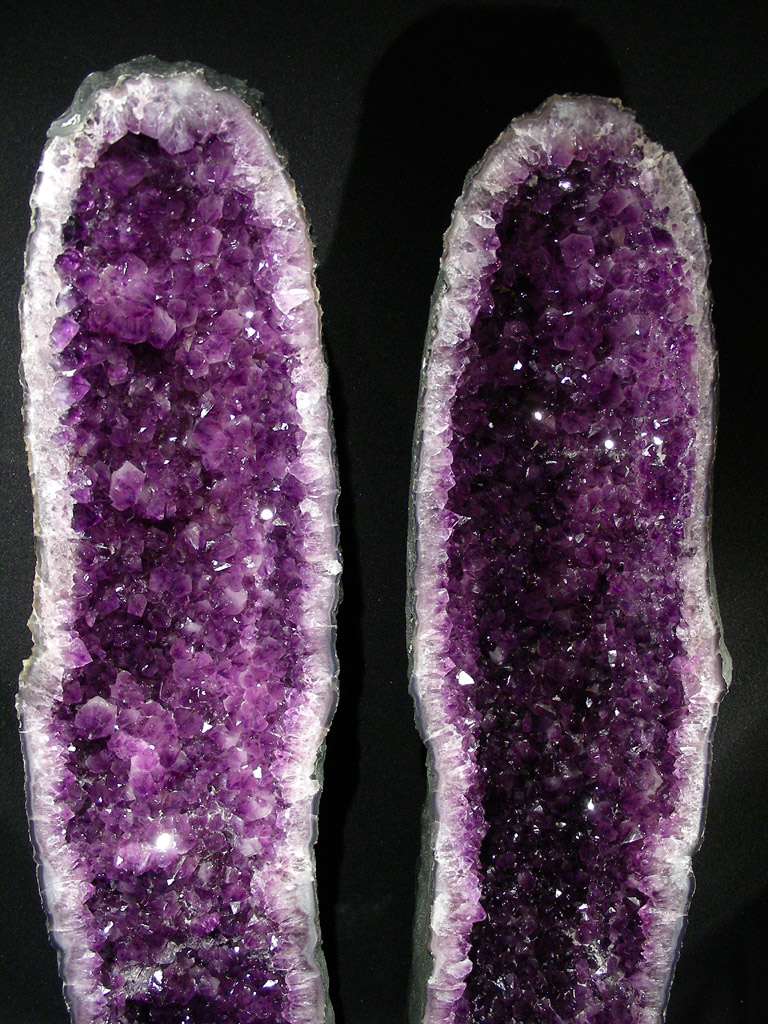
" L'améthyste dont le nom vient du grec amethystos : qui combat l'ivresse, cette pierre servant d'amulette contre l'ivrognerie ! C'est, en effet, dit la légende, le dieu Bacchus qui aspergea le cristal de son vin ce qui le colora. Ce cristal était le résultat de la transformation d'une nymphe importunée par ce dieu…et qui, ainsi put lui échapper.
Le fer sous forme Fe2O3 [oxyde ferrique] peut atteindre 0,25% dans les formes sombres. L'améthyste se décolore vers 400 degrés. Le fer remplace les atomes de silicium [quelques atomes de silicium, une infime fraction] dans le réseau. On aperçoit les zones de coloration en chevrons avec des angles de 60 et 120 degrés si on regarde à la loupe. La valeur de l'améthyste est proportionnelle à sa teinte.
On la retrouve sur les couronnes des rois et surtout sur les anneaux des évêques depuis 610 (et sur ordre du Pape !). On en trouve au Brésil, au Mexique, dans les Alpes et en Auvergne où elles furent exploitées du XVIII ème au XX ème siècle."
Ce qui est frappant, c'est la très faible quantité de fer ( 0,25% seulement !) donnant une coloration violette soutenue du quartz.
Source : Un article de Claire König, enseignante en sciences naturelles, que j'ai déjà croisée lors d'une recherche Internet sur les grès de Collonges-la-Rouge :
http://www.futura-sciences.com/magazines/terre/infos/dossiers/d/geologie-coeur-silice-silex-wafer-567/page/3/

CITRINE :
Et maintenant la citrine, quartz coloré en jaune, ici d'origine naturelle :


" La citrine teintée en jaune, beaucoup plus rare que l'améthyste, elle contient seulement 0,02% d'oxyde de fer. Elle présente les mêmes qualités que l'améthyste, et les citrines foncées sont souvent des améthystes chauffées !". Même source.
AMETRINE :
L'amétrine, combinaison d'amétyste et de citrine dans le même cristal :

"... une spécialité bolivienne, est un cristal très à la mode maintenant. L'aspect bicolore de la gemme est plus percutant sur une pierre taillée. Les Amétrines de la mine Anahí (Bolivie) : La mine Anahí est le principal producteur d'amétrine naturelle au monde mais pendant des années la production resta dans le flou compte tenu de l' extraction dans une réserve naturelle et les pierres allaient au Brésil vu sa proximité .La production est estimée à 10 t/an. L'exploitation se trouve à la base d'une colline (au nord des Mts Tapia) de 200 m surplombant les zones inondées du Pantanal. C'est le fer dont la concentration dépasse 40 ppm qui est à l'origine des couleur."
On parle ici en ppm, parties par million. 100 ppm, c'est 0,01% ! C'est donc vraiment en concentrations infimes que le fer peut colorer le quartz.
Même source.
"Améthyste et citrine sont deux déclinaisons de la famille des quartz. Un traitement thermique à 350° puis à 500° transformera une améthyste en une citrine. Les traces de fer Fe4 qui donne sa couleur violette à l’améthyste se transformant en oxyde de fer, Fe3 qui donne sa couleur jaune aux citrines (pour faire simple). L’amétrine présente naturellement des traces de ces deux déclinaisons d’oxyde de Fer qui engendrent la polychromie d’un même cristal."
Source.
DU QUARTZ FUME AU QUARTZ MORION :


Là Claire König ne précise pas la nature des éléments traces qui donnent la coloration du quartz fumé et du quartz Morion, ni leurs concentrations, plus fortes dans le quartz Morion que dans le quartz fumé. D'autres sites mentionnent des sels d'aluminium plus où mois irradiés naturellement par le granite environnant, mais sans donner de détails scientifiques, ni de concentrations en ppm ou en %. Du coup j'ai approfondi la recherche et suis tombé sur ce résumé d'article scientifique en anglais. Du point de vue scientifique on passe à un niveau supérieur, mais il y a des informations très intéressantes à extraire, ce que je ferai après citation complète du résumé de l'article :
"Abstract :
Color-enhancement investigations without using heating treatment from dull or pale to ideal saturation and/or changes to the formation of the rarer attractive colors are widely conducted to revalue abandoned gem material sources in the world. Such an investigation is carried out on pale or dull purple-colored amethyst and smoky-colored morion samples, which are two important gem species of the crystalline quartz (SiO2) mineral that are currently abandoned in natural deposits in Turkey because of their unattractive coloration. The results of color enhancements observed on these samples, after irradiation with artificial gamma, neutron and beta beams, were examined by comparing with samples with the ideal color saturation and also with colorless samples, using optical absorption (OA) and radioluminescence (RL) spectroscopy. The ICP-AES analyses reveal that the main impurity elements of over 100 ppm in abundance in these quartz species are aluminum, iron and titanium for amethyst, and aluminum, iron, titanium and manganese for morion.The OA spectra indicate that vivid purple coloration of amethyst is due to the transmittance at about 395–420 nm band gap as a result of absorbance peaks at 375, 480 and 530 nm. These absorbances may be related to the unusual oxidized small proportions of certain impurity ions, after being exposed mainly to gamma irradiation, such as Al(IV) from the total aluminum, Ti(V) from the total titanium and Fe(IV) from the total iron, respectively. However, the RL spectroscopy of amethyst samples before and after they were exposed to artificial gamma, neutron and beta radiation beams demonstrates that the ions most affected by irradiation are Fe(IV) first and Al(IV) and Ti(V) second, and these ions represent the RL peaks at 600, 720 and 495 nm, respectively. The OA spectra indicate that dark smoky coloration in morion is due to a lack of transmittance at the visible region as a result of the absorbance peaks at 375, 450–490, 620 and 730 nm. These absorbances also may be related to the unusual oxidized small proportions of certain impurity ions by irradiation, such as Al(IV) from the total aluminum, Ti(V) from the total titanium and Mn(III) from the total manganese, respectively. In addition, the buoyancies of these absorbance peaks in the visible region produce the color hues between light smoky and dark smoky colorations in morion samples. These oxidized ion states are more resistant and stable against environmental destructive conditions in comparison with amethyst. Thus, the dark smoky coloration of morion becomes dull or pale after relatively longer periods. But, the RL spectroscopy of morion before and after being exposed to gamma, neutron and beta irradiation beams demonstrates that the most induced ions from the irradiation are Mn(III) and Al(IV) first and Ti(V) second. These ions represent the RL peaks at about 400, 720 and about 500 nm, respectively."
Radiation Effects and Defects in Solids: Incorporating Plasma Science and Plasma Technology. 2010. Amethyst and morion quartz gemstone raw materials from Turkey: color saturation and enhancement by gamma, neutron and beta irradiation
Source : http://www.tandfonline.com/doi/abs/10.1080/10420150.2010.489611
Cet article scientifique nous confirme que les éléments-traces qui colorent le quartz y sont très faiblement concentrés. Ici, on commence à les prendre en compte à partir de 100 ppm, donc 100 parties par million, qui correspondent à 0,01%, nous l'avons vu plus haut. Il s'agit bien d'éléments traces.
Les principaux éléments traces de l'améthyste sont l'aluminium, le fer et le titane. Comme dans l'eau ferrugineuse, il n'y a donc pas que le fer.
Les principaux éléments traces du quartz Morion sont l'aluminium, le fer, le titane et le manganèse.
Très important, on a une explication scientifique de la coloration violette soutenue de l'améthyste, fondée sur les différentes longueurs d'ondes de la lumière naturelle, exprimées en nanomètres dans cet article (nm). Un petit rappel sur le spectre visible de la lumière naturelle. Aux différentes couleurs correspondent différentes longueurs d'ondes :
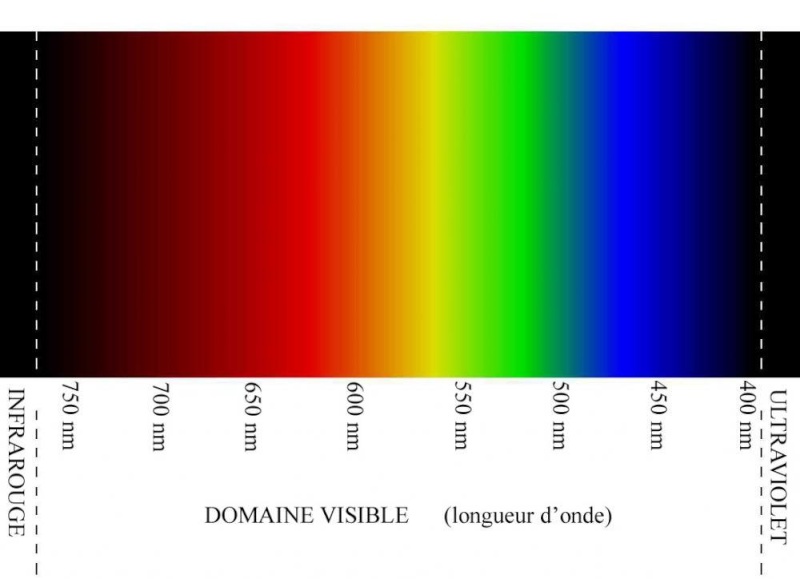
L'améthyste laisse passer les longueurs d'ondes dans une bande passante allant de 395 à 420 nm : On est effectivement en plein dans la partie violette du spectre. L'améthyste comporte des pics d'absorption - elle ne laisse donc pas passer ces fréquences lumineuses, elle les "filtre"- autour de 600, 720 et 495 nm, correspondant respectivement au fer, à l'aluminium et au titane présents en quantités infimes dans les cristaux. Je les ai représentés - ces pics d'absorption- en blanc. Ces raies blanches correspondent donc au maximum de chaque bande d'absorption, ce qui signifie que les fréquences lumineuses sont absorbées de chaque côté, mais avec une intensité décroissante quand on s'éloigne du pic :
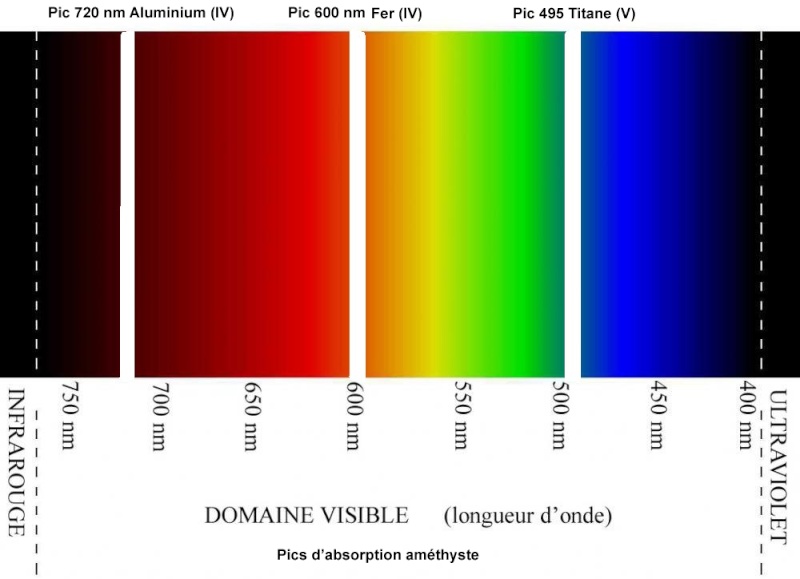
La couleur de l'améthyste correspond donc aux longueurs d'ondes non absorbées par les trois éléments traces principaux contenus dans les cristaux. Il n' a donc pas que le fer qui explique la coloration violette, même si son pic d'absorption centré sur 600 nm est le principal des trois, dans le rouge et l'orange. On est au cœur du phénomène de la couleur. En quantités infimes, un élément trace présent dans le cristal de quartz peut donc absorber une bande de fréquences lumineuses bien précise, centrée sur un pic d'absorption.
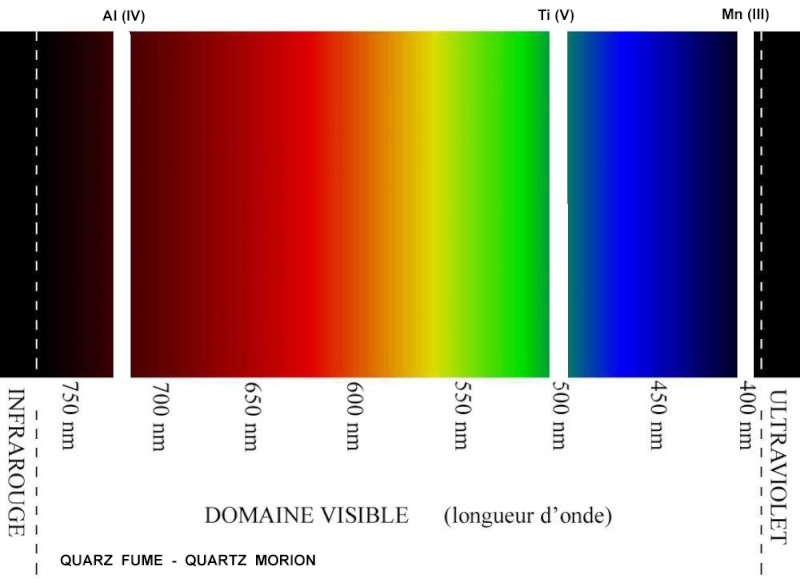
Pour le quartz Morion les éléments traces les plus impliqués dans la coloration sont le manganèse -ions Mn(III)- , et l'aluminium -ions Al(IV), secondairement le titane - ions Ti(V)-. Leurs pics d'absorption respectifs sont autour des longueurs d'ondes de 400, 720 et 500 nanomètres. La grosse différence avec l'améthyste, c'est le manganèse principal à 400 nm pour le Morion alors qu'on avait le fer principal à 600 nm pour l'améthyste. Les bandes d'absorption du quartz Morion - et du quartz fumé quand les absorptions sont moins intenses- :
QUARTZ HEMATOÏDE :



Ici c'est la présence d'hématite, oxyde de fer sous forme Fe2O3, ou de limonite FeO(OH)·nH2O - encore des oxydes mais aussi hydroxydes de fer - qui donnent la coloration rouge : Le fer n'y est donc pas dans le même état chimique que dans l'améthyste où il absorbe le rouge-orangé (pic d'absorption à 600 nm). Je n'ai pas trouvé pour le moment d'ordre de grandeur en ppm ou % de la concentration de ces oxydes de fer dans le quartz pour donner cette magnifique coloration.
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Les fondants.
Les fondants.
Le verre ordinaire, est-ce seulement du sable fondu?
"Le verre peut être obtenu par fusion d'un sable de silice tel le «sable de Fontainebleau». La silice est en effet le composé indispensable pour faire du verre. C'est le «formateur de verre». Mais sa température de fusion très élevée, environ 1750 °C, rend la fabrication particulièrement difficile et onéreuse avec de la silice pure. On ajoute donc des «fondants», tels que la soude, la potasse ou la chaux, qui se combinent à la silice et abaissent sa température de fusion. Par exemple, avec 20% d'oxyde de sodium, la silice fond dès 800°C, et l'on peut alors couler le verre à 1000°C."
http://www.larecherche.fr/idees/back-to-basic/verre-01-10-2004-86298
Les fondants utilisés ont varié dans le temps et l'espace, comme le montre ce tableau extrait de la thèse de doctorat en physique-chimie d'Aurélie Tournié ( Université Pierre et Marie Curie) :
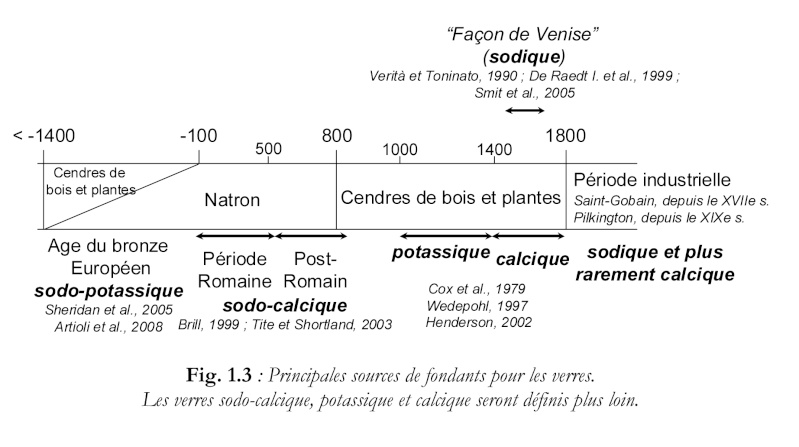
Source : http://www.glvt-cnrs.fr/ladir/pages/theses/These_Aurelie_Tournie.pdf
On voit par exemple que de 1000 à 1400, les fondants médiévauxx étaient des cendres de bois et/ou de plantes, et étaient potassiques. Pour la période industrielle, le fondant dominant est la soude.
Pour le natron, voir seconde vidéo du post ci-dessous :
Dernière édition par Northman le Dim 13 Mar - 11:18, édité 2 fois
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Un choix de vidéos sur la fabrication du verre.
Un choix de vidéos sur la fabrication du verre.
Un peu de détente avec ce reportage sur la fabrication actuelle Archéologie, Egypte. CNRS :
de cristal, émission "C'est pas sorcier" :
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 La transformation du sable en verre suivie en temps réel.
La transformation du sable en verre suivie en temps réel.
La transformation du sable en verre n’est pas complètement comprise. Pour la première fois, des chercheurs français ont suivi le processus en temps réel et à l’échelle microscopique.
Article de "Pour la Science" du 03.05.2012, par Sean Bailly :
"Les premières fabrications de verre datent de 3 000 ans avant notre ère, en Mésopotamie et en Égypte. Les techniques se sont perfectionnées au cours des siècles, l’enjeu majeur étant d’éliminer les cristaux non fondus et les bulles. L’industrie utilise des mélanges de sable et de carbonates, qui existent à l'état fondu à environ 1 050 °C, mais si on n’élève pas plus la température, certains grains de sable ne fondent pas et créent des imperfections dans le verre. On remédie à cette difficulté en portant l’ensemble à 1 500 °C et en laissant le tout dans le four pendant plusieurs jours. Ce procédé élimine les défauts, mais est très coûteux en énergie. Améliorer la technique passe par une compréhension plus fine des processus microscopiques à l’œuvre. Emmanuelle Gouillart, du Laboratoire Surface du verre et interfaces du CNRS/Saint-Gobain à Aubervilliers, et ses collègues ont suivi l’évolution au sein des matières premières du verre grâce à la tomographie aux rayons X.
Les principales matières premières du verre sont du sable – du dioxyde de silicium ou silice – et les carbonates de calcium et de sodium. Le carbonate de sodium agit comme un fondant : il abaisse la température de fusion du mélange – la silice seule fondrait à 1 750 °C. Le carbonate de calcium apporte une protection chimique au verre et le protège en particulier des effets de l’eau. Les interactions entre les cristaux de silice et de carbonates jouent un rôle crucial pour expliquer les différents phénomènes au sein du mélange conduisant à l’apparition des défauts ou à leur absence. À Grenoble, l’ESRF, l’Installation européenne de rayonnement synchrotron, offre les moyens techniques pour étudier en temps réel la transformation du sable en verre. Un faisceau intense de rayons X a été utilisé pour obtenir des images en trois dimensions du mélange. E. Gouillart et ses collègues ont ainsi pu suivre les mouvements des grains dans le mélange, leurs modifications microstructurales et la formation de nouveaux composés lors de réactions, avec une résolution de 1,6 micromètre.
En chauffant progressivement le mélange de silice et de carbonates, on observe divers phénomènes. Au-dessous de 750 °C, au contact de la silice, les cristaux de carbonate de sodium se déforment pour épouser la forme des cristaux de silice. Une réaction entre le sable et le carbonate de sodium (réaction de décarbonatation) est à l’origine de la formation de deux types de silicates de sodium. Simultanément, si un carbonate de calcium est en contact avec un carbonate de sodium, ils forment un carbonate double. Isolé, le carbonate de calcium se dissocie en chaux et en dioxyde de carbone. À partir de 810 °C, les premiers cristaux fondent. La fusion se fait à différentes températures en fonction des éléments en contact. Par exemple, les grains de silice qui ne sont pas entourés de silicate de sodium sont probablement les éléments les plus difficiles à faire fondre – ils sont toujours solides à 900 °C – et peuvent créer des défauts dans le verre. Des pistes pour améliorer la fabrication du verre ? "
La vidéo, réalisée par Emmanuelle Gouillart et ses collègues, illustre les possibilités de suivi en trois dimensions de la tomographie aux rayons X :
"L'interaction d'un grain de carbonate de sodium (en rouge) avec deux grains de silice (bleu et jaune) [Sur la vidéo, le sable est en jaune, pas en bleu] est montrée à différentes températures. Le silicate de sodium (en blanc) formé se dépose sur les grains de silice :"
Source : http://www.pourlascience.fr/ewb_pages/a/actu-la-transformation-du-sable-en-verre-suivie-en-temps-reel-29759.php
Dernière édition par Northman le Mar 15 Mar - 10:10, édité 3 fois
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 La transformation du sable en verre suivie en temps réel (2)
La transformation du sable en verre suivie en temps réel (2)
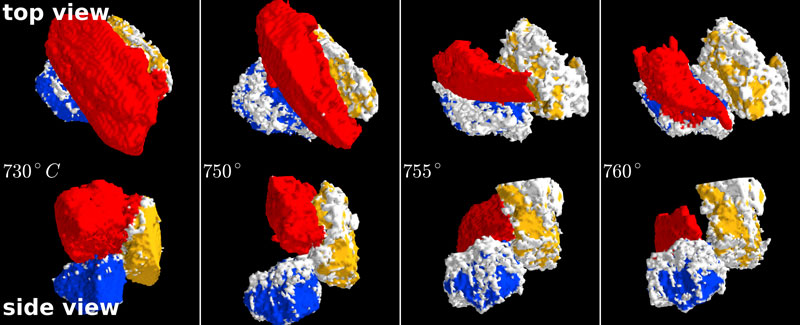
Sur le début de la vidéo, les trois couleurs correspondent à des grains de trois matières différentes, trois constituants de base du mélange qui deviendra verre par fusion :
En jaune : Gains de sable ( donc très riches en SiO2, silice) allant de 160 à 200 microns.
En rouge : Grains de carbonate de sodium ( Na2CO3 : Na étant le sodium, natrum en latin, d'où aussi natron, voir plus haut) allant de 250 à 320 microns. Ce sont les plus gros grains. C'est le fondant, qui nous intéresse tout particulièrement. Rappelons qu'à l'époque médiévale, le fondant était la potasse K2CO3, K étant le potassium, kalium en latin.
En bleu : Grains de carbonate de calcium ( CaCO3) allant de 80 à 100 microns. Ce sont les plus petits grains. C'est le stabilisant du verre.

Sur cette séquence de la chauffe allant croissant de 730° à 760° Celsius, on a l'évolution des grains vue du dessus, en haut, et vue de côté, en bas :

Je pense qu'il y a une erreur dans la légende de cette illustration de l'article scientifique. Les grains bleus ne sont pas des grains de silice, mais toujours des grains de carbonate de calcium. Au cours de cette séquence, on a une nette réduction de la taille du grain de carbonate de sodium, donc du fondant, représenté en rouge. Ce grain de carbonate de sodium rétrécit nettement, fond le premier, au profit de l'apparition de grains blancs qui, au moins sur le grain de silice, représentent du silicate de sodium. C'est donc qu'il y a eu transfert d'atomes de sodium du carbonate de sodium vers la silice pour former du silicate de sodium. C'est cette réaction chimique qui va permettre l'abaissement de la température de fusion de 1750° Celsius pour la silice pure à environ 1050° Celsius pour le mélange silice-fondant, le four étant cependant maintenu à 1500° sur une longue durée pour venir à bout des grains de sable les plus réfractaires.
Cette interaction chimique du sodium - ou du potassium- avec la silice est fondamentale. Elle n'est pas seulement utile pour abaisser la température de fusion : Les atomes de sodium ou de potassium insérés dans le maillage de silice contribuent à donner ses propriétés essentielles au verre, dont la transparence.
Dernière édition par Northman le Mar 15 Mar - 11:08, édité 1 fois
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Le verre, solide non cristallin amorphe.
Le verre, solide non cristallin amorphe.
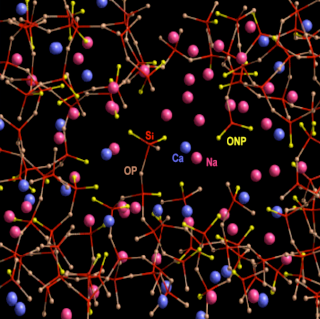
Nous reviendrons un peu plus loin sur le mode d'action des fondants. Nous le comprendrons mieux en passant d'abord par la structure moléculaire du verre refroidi. En voici un exemple de représentation schématique en 3D. On zoome encore fortement pour passer à l'échelle des molécules et des atomes :
Source : http://www.nanosciencenet.org/smno/Chapitre%207.pdf
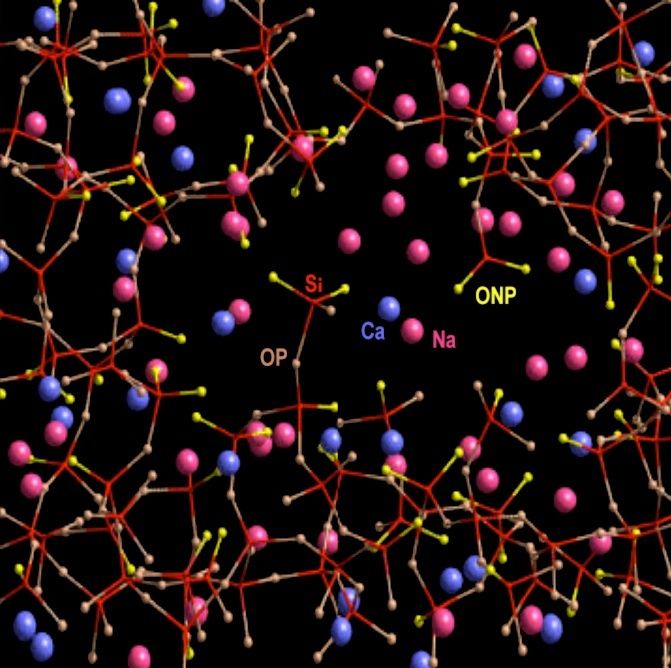
Les bâtonnets reliant les atomes de silicium (non représentés afin d'alléger le schéma, situés au centre des sous-structures à quatre bâtonnets rouges) aux atomes d'oxygène (jaunes ou gris) représentent un type de liaison chimique appelé liaison de covalence. Les atomes de sodium (roses) ou de calcium (bleus) "flottent" dans le verre sans être reliés aux atomes d'oxygène ou de silicium par covalence : Ils ne sont pas reliés par des bâtonnets. En fait ils ne "flottent" pas complètement, car il existe un autre type de liaison, plus faible, que nous verrons plus loin. La structure du verre est dite amorphe et non cristalline, alors que dans la structure cristalline de la silice, tous les atomes sont reliés par covalence :
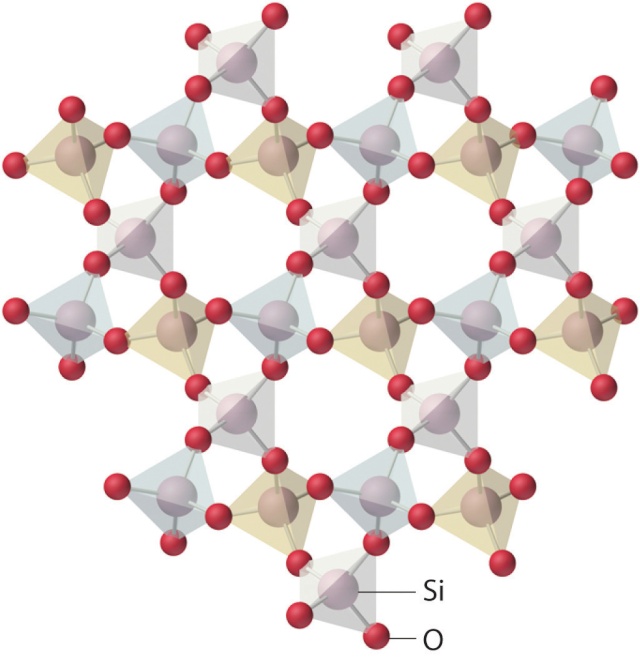
La structure non cristalline du verre présente des lacunes dans lesquelles "flottent" des atomes de sodium - ou de potassium selon le fondant- ainsi que des atomes de calcium. C'est grâce à ces lacunes que le verre est transparent, alors que la silice, cristalline par exemple sous forme de quartz, est tout au plus translucide, comme nous l'avons vu plus haut.
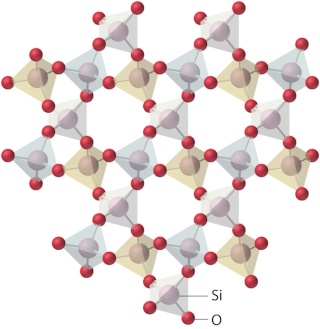
Comparaison de la structure cristalline de la silice et de la structure amorphe et non cristalline du verre :
Pour mieux comprendre la suite, un petit cours très clair sur les molécules polaires :
La silice est elle aussi polaire, et c'est cette polarité qui rend possible l'action des fondants. Nous y reviendrons après un petit intermède ... fulgurant.
Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Création naturelle de verre à partir de sable, sans fondant !
Création naturelle de verre à partir de sable, sans fondant !
Sans fondant, nous avons vu qu'il faut monter très haut en température pour fondre le sable,
à partir de 1750°. La nature peut faire cela :

Ce minéral comportant du verre naturel est appelé fulgurite. Il est créé par l'impact des éclairs orageux sur du sable :
La nature artiste. Une des ces créations fulgurantes mise à nu :


Northman- Messages: 349
Date d'inscription: 17/05/2015 
 Sujets similaires
Sujets similaires» Biberon en verre à col large !
» Recherche des Verre Long Drink F913
» Vends : biberons verre 240 ml Remond
» biberons en verre
» Verre ou plastique?
» Recherche des Verre Long Drink F913
» Vends : biberons verre 240 ml Remond
» biberons en verre
» Verre ou plastique?
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum